| (1) |
室内の温度・・・ |
A点から下ろした点1が室内の温度(乾球温度)です。 |
|
| (2) |
暖房・・・・・・・ | 加湿せず(絶対湿度一定)単純に温度を上げると部屋の空気状態は点2の方向へ移動します。このときの比エンタルピーの増加(hA→h2)は温度上昇に対応しています。 温度上昇に関係する熱は顕熱と言います。 |
|
| (3) |
加湿・・・・・・・ | 加湿のみは、点3の方向へ移動します。 このときの比エンタルピーの増加は温度上昇に使用されず、水蒸気量の増加になっています。 水蒸気に蓄えられた熱を潜熱と言います。 これは物質の状態変化にのみ関係し、温度上昇無関係な熱です。 |
|
| (4) |
露点・・・・・・・ |
A点から温度を下げて(左方)飽和線に当たると相対温度は100[%]となり結露しますので点4が露点を表します。 |
|
| (5) |
絶対温度・・・・・ |
A点から右方に向かった点5は絶対湿度(単位体積中の水蒸気の質量)を表します。 |
|
| (6) |
飽和蒸気圧・・・ |
A点から上方に向かい飽和線に当たると、それがA点の飽和蒸気圧を表します。 |
|
| (7) |
水蒸気分圧・・・ |
A点の水蒸気分圧は、点7で表されますので、相対湿度は下記でも求まります。
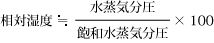 |
|
| *現在は質量とエネルギーは等価であり(E=mC2)、交換可能であるので、エネルギー保存則と質量保存則は不成立となります。質量とエネルギーの総和において保存則が成立します。 |